Es la consecuencia clínica más grave de una hepatopatía, que puede ser el resultado de una destrucción masiva del hígado (insuficiencia hepática fulminante) responsable de 2000 en US. La hepatopatía terminal se produce por la destrucción insidiosa de los hepatocitos o por ondas definidas repetitivas de daño parenquimatoso.
En caso de disfunción hepática grave, la insuficiencia hepática se desencadena por la presencia de enfermedades intercurrentes.
Sea cual sea la secuencia, es necesario perder el 80-90% de la capacidad funcional hepática antes de que aparezca la insuficiencia hepática. El trasplante es la mejor esperanza, la mortalidad sin este es del 80%.
Alteraciones que causan insuficiencia hepática:
- Insuficiencia hepática aguda: enfermedad hepática aguda que se asocia a encefalopatía en los 6 meses siguientes al diagnóstico inicial. Se debe a una necrosis hepática masiva, principalmente inducida por fármacos o toxinas. El paracetamol es responsable del 50% de los casos en US. La exposición de halotano, ATBs (rinfampicina o isoniacida), antidepresivos (inhibidores de la monoaminooxidasa), productos químicos industriales (tetracloruro de carbono) y el envenenamiento por setas (Amanita phalloides) representan el 14%. El HAV del 4%, el HBV del 8% y la hepatitis autoinmunitaria y otras causas desconocidas del 15%. *El HCV sólo causa necrosis hepática masiva raramente.
- Hepatopatía crónica: es la vía más frecuente y es el punto final de una hepatitis crónica inexorable que termina en cirrosis.
- Disfunción hepática sin necrosis evidente: los hepatocitos pueden ser viables, pero incapaces de efectuar su función metabólica normal (intoxicación por tetraciclinas, esteatosis hepática aguda del embarazo).
Clínica
Los signos son consecuencia del fracaso de los hepatocitos para realizar sus funciones:
- Ictericia.
- Hipoalbuminemia -> Edema periférico.
- Hiperamonemia -> Encefalopatía.
- Fetor Hepático: olor característico del cuerpo mohoso o dulce y agrio. Debido a la formación de mercaptanos por acción de las bacterias digestivas sobre la metionina por derivación portosistémica.
- Eritema palmar, angiomas en araña, hipogonadismo y ginecomastia: debido al deterioro del metabolismo de los estrógenos y la hiperestrogenemia.
- Coagulopatía: deterioro de la síntesis de factores de coagulación –> hemorragia digestiva masiva (la absorción intestinal de la sangre es una sobrecarga más al hígado).
Complicaciones Asociadas:
- Encefalopatía
- Síndrome Hepatorrenal
- Síndrome Hepatopulmonar
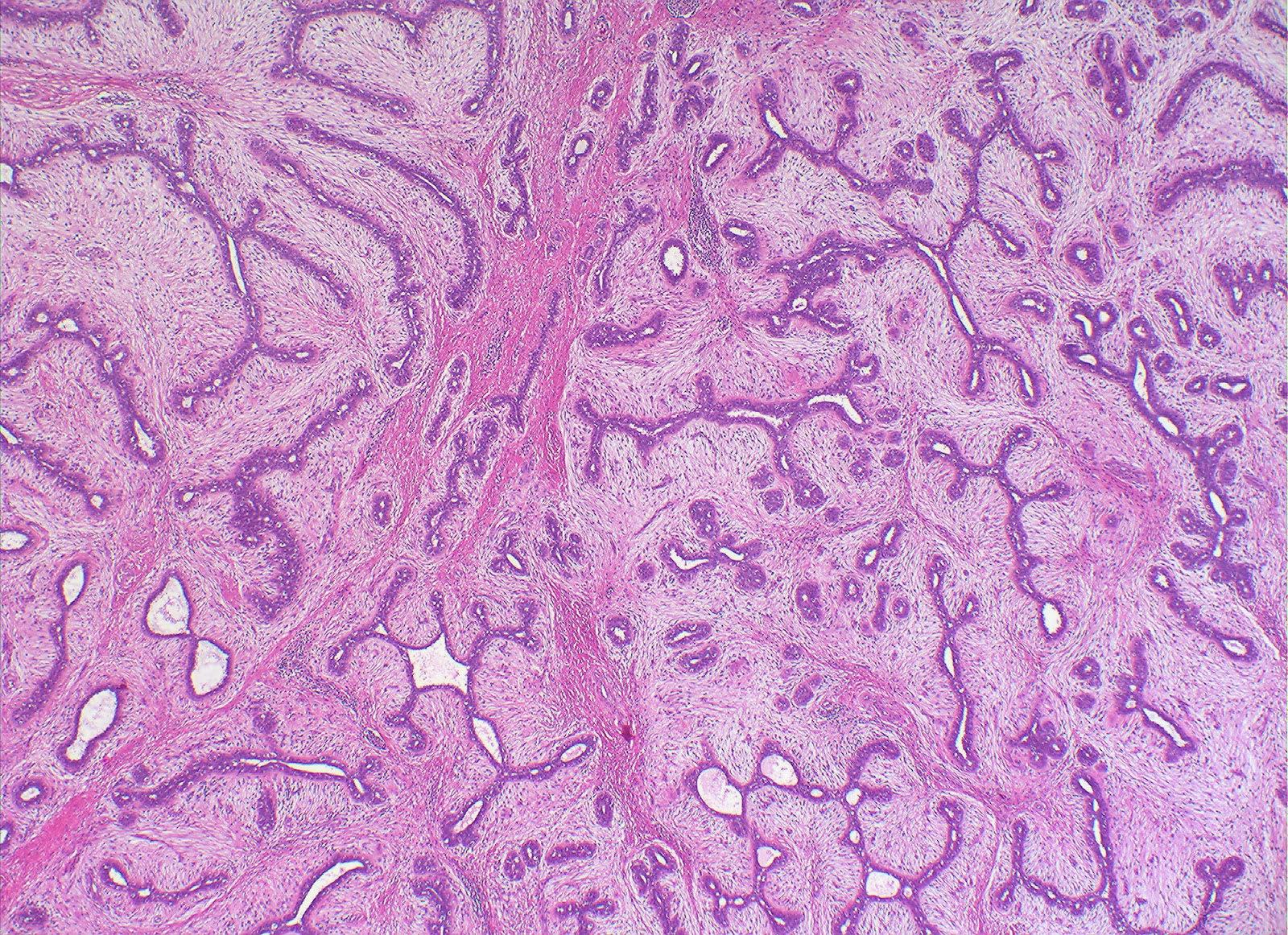
Cirrosis
Ocupa la duodécima causa de muerte en US y es la responsable de la mayoría de las muertes de origen hepático. Sus causas más comunes son el alcohol, la hepatitis vírica y la esteatohepatitis no alcohólica; también son causa la enfermedad biliar y la sobrecarga de hierro.
Morfología:
Es una etapa final de la hepatopatía crónica y se define por:
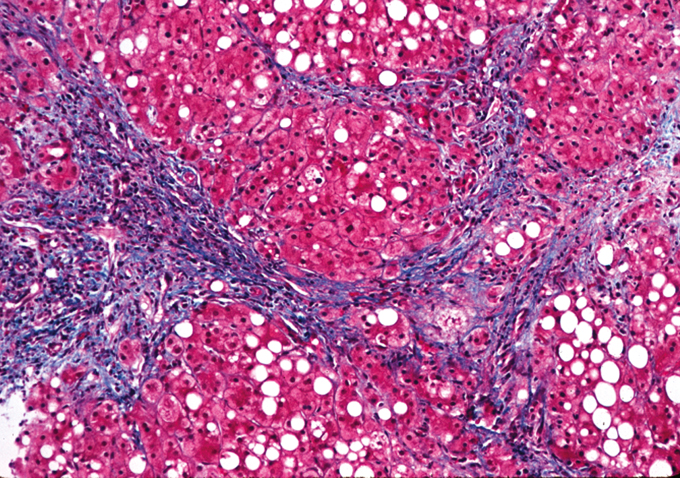
- Tabiques fibrosos en puentes (cicatrices) que unen los espacio porta entre sí y los espacio porta con las venas hepáticas terminales. La fibrosis es la principal característica del daño progresivo en el hígado.
- Los nódulos parenquimatosos que contienen los hepatocitos rodeados por la fibrosis con diámetro variable (<0.3cm o micronódulos a varios centímetros o macronódulos). Es consecuencia de los ciclos de regeneración y cicatrización de los hepatocitos.
- Alteración de la arquitectura de todo el hígado. La lesión parenquimatosa y la fibrosis consecuente son difusas, extendiéndose por todo el hígado (*la lesión focal con cicatrización no constituye una cirrosis).
Patogenia:
Los procesos centrales son la muerte de los hepatocitos, el depósito de matriz extracelular y la reorganización vascular.
El colágeno tipo I y III se deposita en el espacio de Disse (ocupado por colágeno IV) creando tractos septales fibróticos y se acompaña de la perdida de fenestraciones de las células endoteliales sinusoidales (capilarización de sinusoides) que lleva al deterioro de la función de los sinusoides.
Formación de nuevos canales vasculares en los tabiques que conectan los vasos en la región portal con las venas hepáticas terminales creando un cortocircuito para la sangre procedente del parénquima.
El mecanismo predominante de la fibrosis es la proliferación de las células hepáticas estrelladas y su activación en células altamente fibrogenas, pero hay otros tipos de células como fibroblastos portales, fibrocitos y células derivadas de las transiciones epiteliomesenquimatosas que también producen colágeno. La proliferación de las células hepáticas estrelladas y su activación en los miofibroblastos se inicia por una serie de cambios que incluyen el incremente de PDGFR-β (factor β de crecimiento derivado de plaquetas) en las células estrelladas. Al mismo tiempo las células de Kupffer y los linfocitos liberan citosinas y quimiocinas que modulan la expresión génica de las células estrelladas, como el TGF-β y sus receptores, la metaloproteinas
a 2 y los inhibidores tisulares de las metaloproteinasas 1 y 2. La contracción de los miofibroblastos se estimula por la endotelina 1.
Origen de los estimulos de la activación de las células estrelladas:
- Inflamación crónica, con producción de citosinas inflamatorias (TNF, linfotoxina e IL-10) y productos de peroxidacion lipídica.
- Producción de citosinas y quimiocinas por las células de Kupffer, células endoteliales, hepatocitos y células epiteliales de las vías biliares.
- En respuesta a las alteraciones de la MEC.
- Estimulación directa de las células estrelladas por las toxinas.
Clínica:
El 40% de los pacientes cirróticos se mantienen asintomáticos hasta etapas finales.
Los síntomas suelen ser inespecíficos: anorexia, pérdida de peso, debilidad y en casos avanzados los signos y síntomas de la insuficiencia hepática.
Puede aparecer insuficiencia hepática incipiente o franca, precipitada por la carga metabólica superpuesta en el hígado, normalmente como consecuencia de una infección sistémica o hemorragia gastrointestinal.
Los desequilibrios del flujo sanguíneo pulmonar conducen al deterioro grave de la oxigenación (síndrome hepatopulmonar).
El mecanismo último de muerte en los pacientes cirróticos es uno de los siguientes:
- Insuficiencia hepática progresiva.
- Complicación relacionada con la hipertensión portal.
- Desarrollo de un carcinoma hepatocelular.



.jpg)